Những ăn ý hóa học aldehyde và ketone cũng chính là những hóa học xuất hiện tại thật nhiều vô cuộc sống thường ngày, tên thường gọi công cộng của bọn chúng là ăn ý hóa học carbonyl. Cùng dò thám hiểu nội dung bài viết tiếp sau đây với VUIHOC nhằm rất có thể tóm được những kỹ năng và kiến thức cần thiết nhất của phần này và ôn luyện những dạng bài bác luyện thông thường bắt gặp tương quan cho tới ăn ý hóa học carbonyl.
1. Khái niệm và danh pháp của ăn ý hóa học carbonyl
1.1 Khái niệm
- Hợp hóa học carbonyl là những ăn ý hóa học hữu tuy nhiên trong phân tử đem chứa chấp group chức carbonyl. Nhóm chức carbonyl tồn bên trên ở trong số aldehyde, ketone,...
Bạn đang xem: Lý thuyết về hợp chất carbonyl - Hóa 11 chương trình mới

- Aldehyde là ăn ý hóa học hữu tuy nhiên trong phân tử đem chứa chấp group –CHO links thẳng với nguyên vẹn tử carbon hoặc với nguyên vẹn tử hydrogen.
- Dãy đồng đẳng của những aldehyde no, đơn chức và mạch hở đem công thức công cộng như sau: CnH2n+1CHO (với n ≥ 1).
- Ketone là ăn ý hóa học hữu tuy nhiên trong cơ đem chứa chấp group carbonyl links với 2 gốc hydrocarbon.
1.2 Danh pháp
* Danh pháp thay cho thế:

Chú ý:
Đối với những ăn ý hóa học carbonyl mạch nhánh hoặc những hóa học đem gốc hydrocarbon ko no thì việc viết số mạch chủ yếu rất cần phải chính thức kể từ phía này ngay sát với group carbonyl rộng lớn.
* Tên gọi thông thường:
Một số những aldehyde và ketone giản dị và đơn giản được gọi là thương hiệu thường thì và đem xuất xứ lịch sử hào hùng chắc chắn. Tên thường thì của những aldehyde kể từ xuất xứ thương hiệu của những acid ứng.
- Tên thường thì của aldehyde:
Với những aldehyde tuy nhiên acid ứng của chính nó mang tên thường thì thì gọi thương hiệu thường thì của aldehyde cơ bằng phương pháp thay cho đuôi “… ic acid” tự đuôi “ …ic aldehyde” hoặc tự “…aldehyde”.
Ví dụ như bảng bên dưới đây:

- Tên thường thì của ketone:
Một số ketone tiếp tục mang tên thường thì. Ví dụ như:
CH3COCH3 có thương hiệu là Acetone
C6H5COCH3 có thương hiệu là Acetophenone.
Đăng ký ngay lập tức khóa huấn luyện và đào tạo DUO 11 sẽ được lên suốt thời gian ôn đua chất lượng nghiệp sớm nhất!

1.3 Cấu tạo ra của ăn ý hóa học carbonyl
Đặc điểm cấu trúc nổi trội ở những ăn ý hóa học carbonyl là bọn chúng đem links song C=O phân rất rất về phía của nguyên vẹn tử oxygen:


2. Tính hóa học vật lý cơ của ăn ý hóa học carbonyl
- Những aldehyde và ketone sẽ có được nhiệt độ phỏng sôi cao hơn nữa khi đối với những hydrocarbon đem lượng phân tử tương tự.
- Tại nhiệt độ phỏng thông thường, những aldehyde tồn bên trên ở thể khí và đem phân tử khối thông thường nhỏ, tan rất tuyệt ở nội địa. Khi số nguyên vẹn tử carbon tăng thêm thì phỏng tan của ăn ý hóa học carbonyl có khả năng sẽ bị hạn chế dần dần.
- Hầu tựa như những ăn ý hóa học carbonyl thơm sực đều ko tan được nội địa.

3. Tính Hóa chất của ăn ý hóa học carbonyl
3.1 Phản ứng khử ăn ý hóa học carbonyl
Các ăn ý hóa học carbonyl bị khử tự những tác nhân khử bao hàm NaBH4, LiAlH4,... (kí hiệu là [H]) tạo hình nên những alcohol ứng, aldehyde bị khử tạo nên alcohol bậc I ứng, còn ketone bị khử sẽ tạo nên rời khỏi alcohol bậc II.
![\large CH_{3}-CH\xrightarrow[]{LiAlH_{4}}CH_{3}CH_{2}OH](https://latex.codecogs.com/gif.latex?%5Clarge%20CH_%7B3%7D-CH%5Cxrightarrow%5B%5D%7BLiAlH_%7B4%7D%7DCH_%7B3%7DCH_%7B2%7DOH)
![\large CH_{3}-CO-CH_{3}\xrightarrow[]{NaBH_{4}}CH_{3}-CHOH-CH_{3}](https://latex.codecogs.com/gif.latex?%5Clarge%20CH_%7B3%7D-CO-CH_%7B3%7D%5Cxrightarrow%5B%5D%7BNaBH_%7B4%7D%7DCH_%7B3%7D-CHOH-CH_%7B3%7D)
3.2 Phản ứng lão hóa aldehyde
* Oxi hóa aldehyde tự nước bromine:
Aldehyde có khả năng sẽ bị oxi hoá tự nước bromine tạo nên carboxylic acid.
Ví dụ: CH3CHO + Br2 + H2O → CH3COOH + 2HBr
* Oxi hoá aldehyde tự dung dịch demo Tollens
Thuốc demo Tollens là 1 trong phức hóa học của ion Ag+ với group ammonia, đem công thức là [Ag(NH3)2]OH. Ion Ag+ đem vô dung dịch demo Tollens đó là hóa học oxi hoá.
- Thuốc demo Tollens đó là hỗn hợp AgNO3 ở vô NH3 dư:
AgNO3 + 3NH3 + H2O 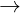 [Ag(NH3)2]OH + NH4NO3
[Ag(NH3)2]OH + NH4NO3
- Phản ứng tổng quát tháo của dung dịch demo Tollens với aldehyde:
R-CH=O + 2[Ag(NH3)2]OH 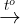 R-COONH4 + 2Ag + 3NH3 + H2O
R-COONH4 + 2Ag + 3NH3 + H2O
Phản ứng như bên trên gọi là phản xạ tráng bạc.
* Oxi hoá aldehyde tự copper(II) hydroxide
Aldehyde rất có thể bị oxi hoá tự copper(II) hydroxide Cu(OH)2 ở vô môi trường xung quanh kiềm khi đun rét sẽ tạo nên rời khỏi kết tủa copper(I) oxide (hay Cu2O) đem red color gạch:
RCHO + 2 Cu(OH)2 + NaOH → RCOONa + Cu2O + 3H2O
Chú ý:
Ketone ko nhập cuộc phản xạ với dung dịch demo Tollens hoặc Cu(OH)2 ở vô môi trường xung quanh kiềm cho nên vì thế rất có thể dùng dung dịch demo Tollens hoặc Cu(OH)2 ở vô môi trường xung quanh kiềm nhằm mục đích phân biệt thân thiện aldehyde và ketone.
Đăng ký đặt ở cuốn sách cán đích 9+ nhằm nhận ưu đãi lên đến mức 50% của vuihoc chúng ta nhé!

3.3 Phản ứng với hydrogen cyanide
Hợp hóa học carbonyl rất có thể nhập cuộc được phản xạ cùng theo với hóa học HCN, nằm trong vô links song C=O.

3.4 Phản ứng tạo ra iodoform
Những ăn ý hóa học aldehyde và ketone đem chứa chấp group methyl cạnh group carbonyl rất có thể nhập cuộc phản xạ với I2, ở vô môi trường xung quanh kiềm.

Phản ứng tạo nên thành phầm kết tủa iodoform cho nên vì thế phản xạ như thế được gọi là phản xạ lodoform và được dùng nhằm phân biệt những aldehyde và ketone đem chứa chấp group methyl cạnh group carbonyl.
4. Ứng dụng và điều chế
4.1 Ứng dụng:
- Formaldehyde hầu hết được dùng trong công việc phát triển vật liệu nhựa, phẩm nhuộm, dược phẩm và hóa học nổ.
Dung dịch formaldehyde ở nội địa được gọi là hỗn hợp formalin chung dìm xác của động thực vật, tẩy uế hoặc khử trùng.
- Acetaldehyde (hay thường hay gọi là ethanal) chung phát triển dược phẩm hoặc những hóa học đem phần mềm cao vô thực dẫn.
- Acetone dùng thực hiện dung môi vô quy trình phát triển tơ tự tạo hoặc dung dịch súng ko sương,… Bên cạnh đó, acetone còn được dùng nhiều vô quy trình tổ hợp Chloroform hoặc dung dịch an thần.

4.2 Điều chế
Trong công nghiệp, một số trong những ăn ý hóa học carbonyl được tổ hợp kể từ cách thức oxi hoá những hydrocarbon, lão hóa ethylene tạo nên acetaldehyde, oxi hoá cumene tạo nên acetone.
- Phương trình pha chế acetaldehyde
2CH2=CH2 + O2![\large \xrightarrow[]{xt,t^{o}}](https://latex.codecogs.com/gif.latex?%5Clarge%20%5Cxrightarrow%5B%5D%7Bxt%2Ct%5E%7Bo%7D%7D) 2CH3-CH=O
2CH3-CH=O
- Phương trình pha chế acetone:

5. Bài luyện về ăn ý hóa học carbonyl
Bài 1: Những aldehyde và ketone tạo nên mùi hương thơm sực đặc thù cho những loại động vật hoang dã và thực vật. phần lớn aldehyde và ketone cũng vào vai trò cần thiết vô khung người như: tế bào võng mạc hỗ trợ cho đôi mắt tiếp có được độ sáng được tạo hình kể từ aldehyde, những hooc môn nam nữ nam giới và phái nữ đem thực chất là những ketone. Hãy cho thấy ăn ý hóa học carbonyl là gì và nó đem những đặc thù nào?
Lời giải:
- Hợp hóa học carbonyl là những ăn ý hóa học hữu tuy nhiên trong phân tử đem chứa chấp group chức carbonyl. Nhóm chức carbonyl xuất hiện tại vô aldehyde, ketone …
- Hợp hóa học carbonyl đem kĩ năng nhập cuộc vô những phản ứng:
+ Phản ứng khử tự những tác nhân khử bao hàm NaBH4; LiAlH4 …
+ Phản ứng cùng theo với HCN, nằm trong vô links song C=O.
+ Những ăn ý hóa học aldehyde và ketone đem chứa chấp group methyl cạnh group carbonyl đem kĩ năng nhập cuộc phản xạ với I2 ở vô môi trường xung quanh kiềm (hay thường hay gọi là phản xạ iodoform).
+ Aldehyde dễ dẫn đến oxi hoá tự những tác nhân oxi hoá thường thì gồm những: Br2/H2O; [Ag(NH3)2]OH hoặc Cu(OH)2/OH−…
Bài 2: Cho biết những ăn ý hóa học dau trên đây đem lượng phân tử tương tự nhau và đem nhiệt độ phỏng sôi như vô bảng bên dưới đây:
| |
CH3CH2CH2CH3 |
CH3CH2CHO |
CH3CH2CH2OH |
| ts (oC) |
-0,5 |
49 |
97,1 |
Hãy đối chiếu nhiệt độ phỏng sôi thân thiện ăn ý hóa học carbonyl với alcohol và ankane đem lượng phân tử tương tự nhau. Dựa vô kĩ năng tạo hình links hydrogen và sự phân rất rất của những phân tử nhằm rất có thể phân tích và lý giải.
Lời giải:
- Những ăn ý hóa học carbonyl sẽ có được nhiệt độ phỏng sôi cao hơn nữa đối với những hydrocarbon đem lượng phân tử tương tự. Vì vô phân tử đem chứa chấp group carbonyl phân rất rất nên phân tử ăn ý hóa học carbonyl cũng phân rất rất.
- Những ăn ý hóa học carbonyl sẽ có được nhiệt độ phỏng sôi thấp rộng lớn đối với những alcohol đem lượng phân tử tương tự. Vì những ăn ý hóa học carbonyl không tồn tại links hydrogen liên phân tử như ở những alcohol.
Bài 3: Phản ứng của ăn ý hóa học aldehyde với dung dịch demo Tollens được tiến hành như sau:
Chuẩn bị: ống thử, ly nước rét, hỗn hợp CH3CHO 5%, hỗn hợp NH3 5% và hỗn hợp AgNO3 1%
Tiến hành:
- Cho vô ống thử khoảng chừng 1 mL hỗn hợp AgNO3 1%.
- Thêm dần dần hỗn hợp NH3 5% vô vào ống thử và nhấp lên xuống đều cho tới thấy lúc kết tủa tan trọn vẹn.
- Nhỏ vài ba giọt của hỗn hợp CH3CHO 5% vô vào ống thử và nhấp lên xuống đều lên.
- Đặt ống thử vô vào một ly đem chứa chấp nước rét (khoảng tầm 70 – 80oC), nhằm yên tĩnh trong tầm 5 phút.
Xem thêm: Quả táo ta tiếng anh là gì và đọc như thế nào cho đúng
Giải mến hiện tượng kỳ lạ ra mắt rất có thể để ý được và ghi chép phương trình hoá học tập mang lại phản xạ ra mắt cơ.
Lời giải:
Hiện tượng: Xuất hiện tại lớp bạc sáng loáng bám ở trở nên ống thử. Vì aldehyde tiếp tục khử ion Ag+ đem vô dung dịch demo Tollens về tinh nghịch thể Ag.
Phương trình hoá học tập như sau:
CH3CHO + 2[Ag(NH3)2]OH 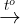 CH3COONH4 + 2Ag + 3NH3 + H2O
CH3COONH4 + 2Ag + 3NH3 + H2O
Sổ tay tổ hợp kỹ năng và kiến thức những môn học tập chung những em đoạt được điểm đua chất lượng nghiệp trung học phổ thông và kỳ đua Review năng lực!!!

Bài 4: Thí nghiệm oxi hoá ăn ý hóa học CH3CHO tự Cu(OH)2 được tổ chức như bên dưới đây:
- Cho 0,5 mL hỗn hợp CuSO4 5% cùng theo với tầm 1 mL hỗn hợp NaOH 10% vô vào ống thử rồi nhấp lên xuống đều lếu ăn ý lên.
- Thêm 1 mL ăn ý hóa học CH3CHO 5% vô vào ống thử, rồi lại nhấp lên xuống đều ống thử lên.
- Đun rét nhẹ nhõm ống thử cơ phía trên ngọn lửa đèn hễ. Hỗn ăn ý phản xạ sẽ dần dần gửi kể từ lếu ăn ý blue color lam lịch sự lếu ăn ý red color gạch men.

Trả điều những thắc mắc bên dưới đây:
a) Khi mang lại hỗn hợp CuSO4 vô với hỗn hợp NaOH, lếu ăn ý tiếp tục tạo ra kết tủa được màu sắc xanh xao lam, kết tủa ấy thực tế là hóa học gì?
b) Viết phương trình hoá học tập của những phản xạ tiếp tục xẩy ra vô thực nghiệm trình bày bên trên.
Lời giải:
a) Khi mang lại hỗn hợp CuSO4 vô với hỗn hợp NaOH thì lếu ăn ý sẽ tạo nên rời khỏi kết tủa được màu sắc xanh xao lam, kết tủa ấy đó là copper(II) hydroxide (hay Cu(OH)2).
b) Phương trình hoá học tập của những phản xạ tiếp tục xảy ra:
CuSO4 + 2NaOH 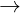 Cu(OH)2 + Na2SO4
Cu(OH)2 + Na2SO4
CH3CHO + 2Cu(OH)2 + NaOH 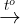 CH3COONa + Cu2O + 3H2O
CH3COONa + Cu2O + 3H2O
Bài 5: Viết công thức cấu trúc tương đương gọi thương hiệu thay cho thế của những aldehyde đem công cộng công thức là C5H10O.
Lời giải:
Aldehyde C5H10O được thể hiện tại ở trên bảng bên dưới đây:

Ketone C5H10O được thể hiện tại ở trên bảng bên dưới đây:

Bài 6: Em hãy dò thám hiểu thêm thắt bên phía ngoài và trình diễn về những phần mềm của một số trong những aldehyde.
Lời giải:
Ứng dụng của một vài ba aldehyde cơ là:
+ Formaldehyde được dùng hầu hết nhằm mục đích phát triển vật liệu nhựa bao hàm poly(phenol – formaldehyde) hoặc urea formaldehyde. Formaldehyde cũng khá được người sử dụng với mục tiêu phát triển phẩm nhuộm, dược phẩm và hóa học nổ. Dung dịch chứa chấp 37% - 40% formaldehyde ở nội địa, hoặc còn được gọi là formalin, được dùng nhằm mục đích dìm xác những động thực vật hoặc tẩy uế và khử trùng.
+ Acetaldehyde (hay ethanal) được dùng nhiều vô quy trình tổ hợp cơ học nhằm pha chế rời khỏi nhiều loại dược phẩm hoặc những hóa học đem phần mềm cao vô thực dẫn. Ví dụ kể từ acetaldehyde, người tao rất có thể pha chế được hóa học ethylidene diacetate dùng vô quy trình phát triển poly(vinyl acetate).
+ Acetone đem kĩ năng hoà tan chất lượng nhiều những hóa học cơ học không giống nhau (bao bao gồm cả những polymer như cellulose trinitrate). Vì thế tuy nhiên một lượng rộng lớn acetone được dùng thực hiện dung môi vô quy trình phát triển tơ tự tạo hoặc dung dịch súng ko sương … Bên cạnh đó, acetone còn được dùng nhiều vô quy trình tổ hợp cơ học như chung tổ hợp nên bisphenol – A, chloroform hoặc dung dịch an thần solfonal, …
+ phần lớn ăn ý hóa học carbonyl chiếm hữu mùi hương thơm sực riêng lẻ và được dùng với tầm quan trọng thực hiện hóa học tạo ra hương thơm ở vô công nghiệp đồ ăn thức uống hoặc mĩ phẩm: Benzaldehyde là hóa học đem mùi hương và mùi vị ở ngược hạnh nhân, cinnamaldehyde đem mùi hương thơm sực ở tinh chất dầu quế, vanillin là hóa học chung tạo ra hương thơm chủ yếu vô mùi hương thơm sực của kem vani, methone đem mùi hương thơm sực đặc thù của bạc hà và citral mang lại mùi hương thơm sực thông thoáng của tinh chất dầu xả.
Bài 7: Trả điều những thắc mắc bên dưới đây:
- Vận dụng những kỹ năng và kiến thức tiếp tục học tập về ăn ý hóa học carbonyl nhằm phân tích và lý giải về: những phần mềm của những aldehyde và ketone ở vô cuộc sống thường ngày bao hàm quy trình phát triển gương hoặc thực hiện dung môi,…
- Tìm hiểu về những phần mềm của những ăn ý hóa học aldehyde và ketone đem vô bất ngờ cùng theo với những tầm quan trọng của một số trong những aldehyde và ketone cần thiết so với khung người quả đât.
Lời giải:
- Phản ứng thân thiện aldehyde với dung dịch demo Tollens tạo nên lớp bạc mỏng tanh, sáng loáng bám ở trở nên bình nên phản xạ này được phần mềm vô quy trình phát triển gương.
- Một số ăn ý hóa học carbonyl đem kĩ năng hoà tan chất lượng những hóa học cơ học không giống nhau (bao bao gồm cả những polymer) nên được phần mềm thật nhiều với tầm quan trọng dung môi.
- Trong bất ngờ, những ăn ý hóa học đem chứa chấp group chức của aldehyde và ketone tồn bên trên phổ cập ở vô tinh chất dầu của những loại cây trồng được sử dụng thực hiện hóa học tạo ra nguyên liệu vô công nghiệp đồ trang điểm hoặc đồ ăn thức uống.
- Trong khung người người, một lượng rất rất không nhiều acetone được tạo hình qua quýt quy trình gửi hoá của hóa học Khủng ko trọn vẹn. Tại người khoẻ mạnh thông thường, acetone được tạo nên ở gan liền và được gửi hoá gần như là trọn vẹn, chỉ từ một lượng rất rất nhỏ xuất hiện ở thủy dịch. Sự xuất hiện tại không bình thường của acetone ở vô thủy dịch là 1 trong tín hiệu của những người mắc bệnh đái lối và được phân phát hiện tại trải qua quy trình xét nghiệm thủy dịch (chính là chỉ số KET).
Bài 8: tường công thức cấu trúc của những hóa học carbonyl đem công thức phân tử công cộng đều là C3H6O. Trình bày tối thiểu nhì cách thức hoá học tập chung phân biệt được những hóa học cơ. Lập sơ trang bị (hoặc lập bảng), ghi rõ rệt rời khỏi những hiện tượng kỳ lạ và ghi chép những phương trình hoá học tập nhằm phân tích và lý giải được yếu tố.
Lời giải:
Công thức rất có thể đem của những ăn ý hóa học carbonyl là: CH3–CH2–CHO và CH3–CO–CH3.
Phương pháp chất hóa học như sau:
-
Aldehyde khi phản xạ với dung dịch demo Tollens sẽ tạo nên rời khỏi kết tủa color xám bạc.
-
Aldehyde khi phản xạ với Cu(OH)2 ở vô môi trường xung quanh kiềm tạo hình nên kết tủa đem red color gạch men (hay Cu2O).
-
Hợp hóa học đem chứa chấp group methyl ketone (hay CH3CO-R) khi phản xạ với iodine ở vô môi trường xung quanh kiềm sẽ tạo nên rời khỏi kết tủa iodoform được màu sắc vàng.
| Thuốc thử |
CH3-CH2-CHO |
CH3-CO-CH3 |
| Tollens |
Kết tủa xám bạc |
x |
| Cu(OH)2/OH- |
Kết tủa đỏ chót gạch |
x |
| I2/NaOH |
x |
Kết tủa vàng |
PTHH:
CH3-CH2-CHO + 2[Ag(NH3)2]OH 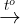 CH3-CH2-COONH4 + 2Ag + 3NH3 + H2O
CH3-CH2-COONH4 + 2Ag + 3NH3 + H2O
CH3-CH2-CHO + 2Cu(OH)2 + NaOH 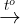 CH3-CH2-COONa + Cu2O + 3H2O
CH3-CH2-COONa + Cu2O + 3H2O
CH3COCH3 + 3I2 + 4NaOH ⟶ CH3COONa + CHI3 + 3NaI + 3H2O
Bài 9: Hợp hóa học cơ học kí hiệu là X được dùng nhiều vô quy trình tổ hợp cơ học. phẳng cách thức phân tách nhân tố, người tao tiếp tục xác lập được ăn ý hóa học X đem chứa chấp 62,07%C; 10,34%H và sót lại là nhân tố O (xét về khối lượng). Trên phổ MS của ăn ý hóa học X, người tao thấy xuất hiện tại peak ion phân tử [M+] có mức giá trị m/z là 58. Trên phổ IR của X xuất hiện tại một tín hiệu rất rất đặc thù vô vùng 1 670 – 1 740 cm-1. Hợp hóa học X ko nhập cuộc phản xạ với Cu(OH)2 ở vô môi trường xung quanh kiềm nhằm tạo hình kết tủa đem red color gạch men. Hãy xác lập công thức cấu trúc của ăn ý hóa học X.
Lời giải:
Phần trăm lượng của nhân tố O là:
100% - 62,07% - 10,34% = 27,59%
Gọi công thức giản dị và đơn giản nhất của ăn ý hóa học X là CxHyOz. Ta có:
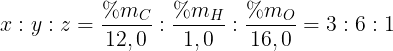
Công thức giản dị và đơn giản nhất của ăn ý hóa học X chủ yếu là: C3H6O
Mà phân tử khối của ăn ý hóa học X là 58 vì thế có mức giá trị m/z của peak [M+] đó là 58.
=> (12.3 + 1.6 + 16).n = 58.n = 58 => n = 1.
Vậy ăn ý hóa học X đem công thức phân tử là: C3H6O.
Trên phổ IR của ăn ý hóa học X mang trong mình một tín hiệu rất rất đặc thù ở vô vùng 1 670 – 1 740 cm-1 => X đem chứa chấp links C=O ở vô phân tử.
Hợp hóa học X ko nhập cuộc phản xạ với Cu(OH)2 ở vô môi trường xung quanh kiềm nhằm tạo hình kết tủa đem red color gạch men => Hợp hóa học X ko nên là aldehyde, X đó là ketone.
Vậy công thức cấu trúc của ăn ý hóa học X đó là CH3-CO-CH3.
Bài 10: Cho 3 hóa học cơ học là A, B và C đem công cộng công thức phân tử là C3H6O. Chất A đem nhập cuộc phản xạ tráng bạc; hóa học B ko nhập cuộc phản xạ tráng bạc tuy nhiên lại nhập cuộc phản xạ tạo ra iodoform; hóa học C là hóa học làm mất đi color của nước bromine. Khi hydrogen hoá hóa học C rồi oxi hoá thành phầm thì chiếm được hóa học A. Xác quyết định công thức cấu trúc và xác lập tên thường gọi của những hóa học A, B, C theo gót danh pháp thay cho thế.
Lời giải:
Chất A đem nhập cuộc phản xạ tráng bạc => Hợp hóa học A đó là aldehyde.
Chất B ko nhập cuộc phản xạ tráng bạc tuy nhiên lại nhập cuộc phản xạ tạo ra iodoform => Hợp hóa học B đem chứa chấp group methyl ketone.
Chất C làm mất đi color của nước bromine, hydrogen hoá hóa học C rồi oxi hoá thành phầm thì chiếm được hóa học A => Chất C đem chứa chấp links song và là 1 trong alcohol bậc 1.
| Chất |
Công thức cấu tạo |
Tên gọi |
| A |
CH3-CH2-CHO |
propanal |
| B |
CH3-CO-CH3 |
propanone |
| C |
CH2=CH-CH2-OH |
2-propen-1-ol |
PAS VUIHOC – GIẢI PHÁP ÔN LUYỆN CÁ NHÂN HÓA
Khóa học tập online ĐẦU TIÊN VÀ DUY NHẤT:
⭐ Xây dựng suốt thời gian học tập kể từ mất mặt gốc cho tới 27+
⭐ Chọn thầy cô, lớp, môn học tập theo gót sở thích
⭐ Tương tác thẳng hai phía nằm trong thầy cô
⭐ Học tới trường lại cho tới lúc nào hiểu bài bác thì thôi
⭐ Rèn tips tricks chung bức tốc thời hạn thực hiện đề
⭐ Tặng full cỗ tư liệu độc quyền vô quy trình học tập tập
Đăng ký học tập demo free ngay!!
Xem thêm: Seaborgi

Sau khi gọi nội dung bài viết, có lẽ rằng những em tiếp tục phần này tóm được kỹ năng và kiến thức về hợp hóa học carbonyl. Bài ghi chép bên trên không chỉ là tổng hợp lý và phải chăng thuyết về ăn ý hóa học carbonyl tuy nhiên còn hỗ trợ những em ôn luyện tự những dạng thắc mắc đem đáp án. Nếu mong muốn học tập thêm thắt những kỹ năng và kiến thức không giống nằm trong môn Hoá học tập 11 hoặc bất kể môn học tập này không giống, nhanh tay để kịp truy vấn vô trang web goiviettel.vn và ĐK những khoá học tập phù phù hợp với bạn dạng thân thiện với mọi thầy cô VUIHOC ngay lập tức thời điểm ngày hôm nay nhé!
>> Mời những em tìm hiểu thêm thêm:
- Phenol
- Alcohol
- Dẫn xuất halogen
















